本文經訊聯基因數位股份有限公司(原名:創源生技)同意轉載
前言
Ingenuity Pathway Analysis (IPA) 為專門解析生物學數據的強大工具,特別適用於體學研究。經過20多年的累積發展,IPA 已成為研究人員深入理解基因和蛋白質相互作用的首選平台。它不僅能揭示特定生物學過程中的分子機制,還能洞察疾病的潛在機制,為免疫反應與疾病進展的研究提供關鍵支持,進而加速標靶藥物的開發進程。
背景
肝細胞癌(HCC)是肝癌中最常見的類型,與慢性B型肝炎病毒(HBV)感染密切相關。在全球範圍內,85%以上的肝癌病例與慢性HBV感染有關,而其中55%到80%的HCC患者都是由於慢性HBV感染所導致。HBV的持續感染及其引發的慢性炎症,通過多種機制,特別是HBV X蛋白及表觀遺傳修飾,促進了HCC的發展。
在免疫反應中,CD8+ T細胞扮演了控制HBV感染及抑制HCC發展的重要角色。然而,由於免疫反應的複雜性,如T細胞耗竭的現象,使得理解和針對這些免疫反應進行治療變得具有挑戰性。
研究方法
研究者首先從HCC患者的腫瘤組織和周邊血中分離淋巴細胞,並利用流式細胞儀和CyToF質譜法進行免疫細胞表型,識別出不同T細胞群體,尤其是腫瘤駐留記憶性T細胞(Trm)和耗竭型T細胞。此外研究者採用單細胞RNA定序技術(single cell RNA-seq, scRNA-seq)對T細胞進行RNA 表現量分析,scRNA-seq數據經過標準化,t-SNE和UMAP降維技術(dimension reduction)分析,並利用分析工具進行細胞亞群的鑑別和聚類分析(cluster analysis)。這使單細胞層面上測量差異基因表現量更為精確,從而更深入理解不同T細胞亞群在腫瘤中的作用。
路徑分析
研究者使用單細胞RNA定序技術對T細胞進行基因表達分析,深入理解不同T細胞亞群在腫瘤中的作用。除了基因表現量差異分析,還應用了基因富集分析(Gene Set Enrichment Analysis, GSEA),這一技術能幫助研究者識別在不同T細胞亞群中顯著富集的基因集和生物學過程。除此之外,為了進一步探究基因表達數據所參與的路徑與網路,研究者還使用了Qiagen Ingenuity Pathway Analysis (IPA) 進行路徑和網路分析。IPA 的獨特優勢在於其強大的數據整合能力和預測分析功能。通過分析已知的生物路徑和分子交互作用網路,IPA 不僅能解釋實驗結果,還能提出新的生物學假設,這是其他分析工具難以企及的。IPA 的另一大優勢在於其能夠協助研究新穎且未定義的生物學機制,以及識別潛在的治療標靶,這對於推進科學前沿和藥物開發至關重要。在本研究中,IPA 的應用使得研究者能夠精確識別出與T細胞功能及耗竭相關的關鍵分子路徑,並預測這些通路在不同T細胞亞群中的作用,為後續的實驗設計和理論驗證提供了可靠的方向。
結果
多層次分析肝細胞癌(HCC)患者免疫反應
本研究中涵蓋了多種抗原庫,包括腫瘤相關抗原、HBV抗原、disease-unrelated和腫瘤新抗原(Neoantigen)。分析來自46名HCC患者的不同樣本,包括周邊血(PBMC)、健康肝臟組織(HM)和腫瘤組織(HCC)中的T細胞反應。研究採用了多重pMHC四聚體分析和質譜細胞成像來定量這些樣本中的抗原特異性T細胞。
在27位患者不同樣本中針對特定抗原的T細胞反應。結果顯示,在HCC樣本中,特異性T細胞的比例明顯高於PBMC和HM樣本,尤其是針對HBV和AFP抗原的反應更為顯著。這表明HCC腫瘤微環境中存在強化的抗原特異性免疫反應。計算所有樣本抗原表現位置數量,顯示出腫瘤抗原和HBV抗原在HCC樣本中的豐富度較高,尤其是與腫瘤進展相關的抗原表位。相對而言,disease-unrelated和新抗原的表位檢測較少,這表明它們在HCC免疫反應中的角色可能較小。不同特性樣本之間的抗原特異性T細胞反應的差異,明確指出HCC樣本中針對腫瘤抗原和HBV抗原的T細胞反應最為強烈。這些結果強調了HCC腫瘤微環境中強化的抗原特異性免疫反應,尤其是針對HBV抗原的反應,可能在HCC的免疫調控中扮演關鍵角色,並提示這些抗原可作為免疫治療的潛在目標。
肝細胞患者T細胞免疫反應,單細胞分群以及功能測試
對來自周邊血液、肝臟組織和腫瘤組織中的T細胞進行了scRNA表現分群分析。結果顯示,HCC腫瘤中浸潤的T細胞(TILs T cells)(特別是腫瘤駐留記憶T細胞和部分耗竭的T細胞)與周邊血液中的T細胞顯著差異,顯示這些細胞在腫瘤微環境中可能具有特定的免疫功能。這些T細胞中,特異性針對HBV抗原的T細胞表現出部分耗竭的狀態,但仍保留了一定的效應功能,這表明儘管長期暴露於抗原,這些細胞仍具有一定的抗腫瘤潛力。
研究還識別出在HCC和HBV感染相關抗原中顯著富集的T細胞,這些抗原特異性T細胞在腫瘤微環境中高頻率出現,並展現出高活性的免疫反應。這一發現進一步強調了腫瘤微環境中持續的抗原驅動T細胞反應。
最重要的是,研究發現某些T細胞特徵(如耗竭的HBV特異性T細胞和腫瘤駐留記憶T細胞)與患者的臨床預後密切相關,這些細胞的高豐度與較差的無病生存期(DFS)相關聯。
路徑分析
研究者進一步顯示肝細胞癌(HCC)患者的抗原特異性T細胞反應如何影響患者的臨床預後。研究通過分析HCC組織中不同抗原(特別是HBV抗原)特異性T細胞的活性,了解這些T細胞與疾病進展之間的關聯。結果顯示,針對特定腫瘤抗原的
T細胞在腫瘤微環境中的豐富度和活性程度,與患者的臨床結果有著密切關聯。具體而言,表現耗竭標誌的T細胞群體與較差的臨床預後相關,這暗示了這些T細胞在疾病惡化中的潛在角色。研究指出,在一些患者中,雖然T細胞顯示出耗竭的狀況,但仍然保有一定的效應功能,這為潛在的免疫治療提供了新的思路。
GSEA 與 IPA 的比較
在這項研究中,Gene Set Enrichment Analysis(GSEA)作為一種經常使用的分析工具,能夠有效地識別出特定基因集在不同樣本中的富集情況。然而,GSEA的分析範圍主要限於基因的富集層面,無法提供更深入的網路或路徑層面的資訊。GSEA的分析仰賴研究者制定或是已知的基因集(Gene set),較無法深入探究新穎路徑或是基因間的交互作用。相比之下,Ingenuity Pathway Analysis(IPA)提供了一個更為全面且先進的分析平台,能夠將基因表達數據與已知的生物學網路和途徑相整合。IPA不僅可以顯示出基因在特定通路中的作用,還能深入探索基因之間的複雜交互作用和調控網路,從而提供對生物學過程更深層次的理解。在本篇研究中,IPA的應用使得研究者能夠精確鑑別出與HCC相關的關鍵途徑和分子網絡,並通過這些途徑進一步理解T細胞的功能狀態和其對臨床預後的影響。IPA的優勢在於它能夠提供一個整體性的系統生物學觀點,使研究者更好地理解基因之間的相互作用與其在疾病進展中的複雜角色,這對於開發新的治療策略和精準化醫療方案至關重要。此外,IPA的預測分析功能還能幫助研究者預見潛在的治療靶點和生物標誌物,大大加速了從基礎研究到臨床應用的轉化過程。
結論
這篇研究揭示了在HCC腫瘤微環境中,T細胞群體展現出顯著的異質性和功能狀態。結果顯示,儘管HBV特異性T細胞在HCC患者中表現出部分耗竭的表型,但仍然保留一定的抗腫瘤效應功能,這些細胞與患者的臨床預後密切相關。研究進一步強調了腫瘤微環境中抗原特異性T細胞的豐富度與HCC進展之間的聯繫,指出這些免疫反應在肝癌的發展和預後中具有重要作用。這些發現為未來的免疫療法提供了新的視角,尤其是在設計針對HCC的精準治療方案時,可以考慮如何優化T細胞功能以增強抗腫瘤免疫反應。此外,這些結果也強調了進一步研究T細胞在腫瘤微環境中行為的必要性,為開發新的預後標誌物和治療策略提供了寶貴的基礎。
Reference :
Non-terminally exhausted tumor-resident memory HBV-specific T cell responses correlate with relapse-free survival in hepatocellular carcinoma Cheng et al., 2021, Immunity 54, 1825–1840

圖一: 對肝細胞癌(HCC)和健康肝組織中的抗原特異性T細胞進行廣泛的pMHC四聚體分析
A. 使用多重組合pMHC四聚體策略,分析針對腫瘤抗原(TA)、B型肝炎病毒(HBV)、 disease-nonrelated 和新(Neo)抗原的T細胞反應,並通過CyTOF質譜檢測。B. 患者27的T細胞分析,展示了PBMC、健康肝組織(HM)和HCC樣本中不同抗原特異性T細胞的反應。C. 檢測到的表位數量。HCC樣本中特異性表位的數量明顯多於其他樣本,特別是針對TA和HBV抗原。D. 患者46的T細胞分析,展示了不同樣本中抗原特異性T細胞的分布。E. 各樣本中針對不同抗原的特異性T細胞的豐富度比較,顯示出HCC樣本中TA和HBV特異性T細胞的明顯富集。F. 不同抗原特異性T細胞反應在PBMC、HM和HCC樣本中的頻率,顯示出HCC樣本中針對TA和HBV抗原的強化反應
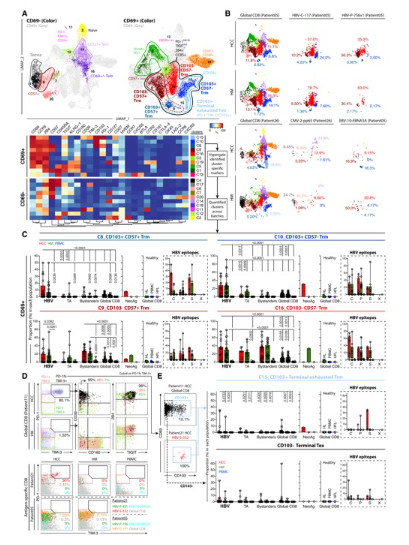
圖四. 高維度分析確定了患者肝臟中五個不同的抗原特異性 Trm 細胞亞群
A. 使用CyTOF分析來自HCC患者的HBV特異性T細胞的表型,並通過t-SNE圖展示不同樣本中T細胞的分佈情況。B. 展示了不同樣本(PBMC、健康肝組織(HM)、HCC)中HBV特異性T細胞群體的異質性,並分析了這些T細胞的效應和耗竭標誌物。C.基於T細胞亞群在不同樣本中的比例,顯示出HCC中HBV特異性T細胞的耗竭表現型增加。D. 使用Flow Cytometry分析進一步驗證HBV特異性T細胞的表型差異,特別是在HCC樣本中耗竭標誌物的表現。
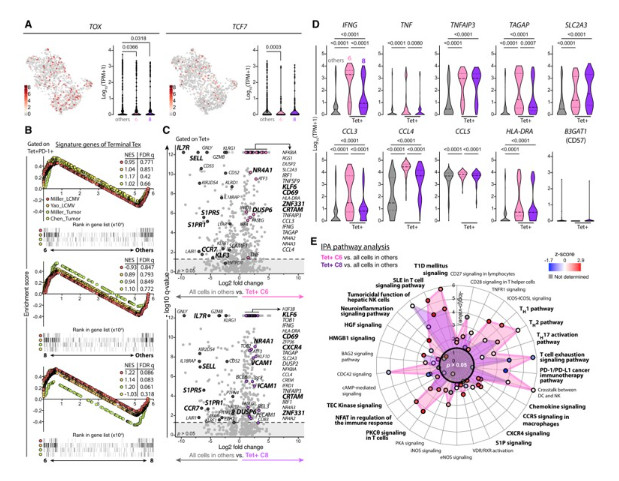
圖六. 腫瘤內和肝組織中 HBV 特異性 CD8+ T 細胞是有功能的 Trm 非末期Tex 細胞
(A) UMAP 上顯示了單一細胞中 TOX 和 TCF7 基因的表達(以 log10TPM 為單位),並且在小提琴圖中顯示各群之間的比較。(B) GSEA 分析四種不同差異表現量的特徵基因組cluster 6 vs other cluster(上), cluster 8 與other cluster(中),或cluster 6 與 cluster 8(下),在terminal Tex cells 基因特徵裡每個的標準化富集分數 (NES) 和 FDR q 值。(C) 火山圖顯示cluster 6 或 cluster 8 中的Tetra+細胞與other clusters的所有細胞相比基因表現的倍數變化。選定的基因被突出顯示為彩色。(D) cluster 6 和 cluster 8 中的抗原特異性 T 細胞與來自other cluster的細胞之間選定基因的 mRNA 表現量以小提琴圖呈現。(E) cluster 6 或 cluster 8 中的四聚體 + 細胞與other cluster中所有細胞的比較顯示為雷達圖,顯示 –log(p value)和 前30名路徑 的 Z 分數。