本文經訊聯基因數位股份有限公司(原名:創源生技)同意轉載,原文出處:
https://www.gga.asia/tc/Product_Information/BioInformatic/about_news_detail/4040
QIAGEN Ingenuity Pathway Analysis (IPA) 是生命科學研究領域領先的路徑分析軟體,使用 IPA來整理公開文獻資料可以提供對基因、蛋白質、信號路徑和生物學功能之間的關聯性 ,並有助於識別相關的分子和潛在的交互作用。 IPA整合QIAGEN知識資料庫及第三方資料庫, 讓研究者能夠快速的在數千萬筆的研究資料中,找到最關鍵的生物路徑與分子間調控關係。
研究簡介
α-突觸核蛋白 (α-synuclein) 是由 SNCA基因編碼的一種人類蛋白質。作為神經元蛋白,α-突觸核蛋白調節突觸小泡的運輸以及隨後的神經傳遞物質的釋放。在大腦中,它主要存在於突觸前神經元的末端,通過與磷脂和蛋白質進行交互作用來釋放化學信號,稱為神經傳遞物質。神經傳遞物質的釋放在神經元之間傳遞信號,對正常的大腦功能至關重要。
而許多研究證明,在大腦中錯誤折疊的α-突觸核蛋白會形成聚集體, 進而堆積成團塊,導致腦細胞死亡 。這也是造成帕金森氏症的原因。
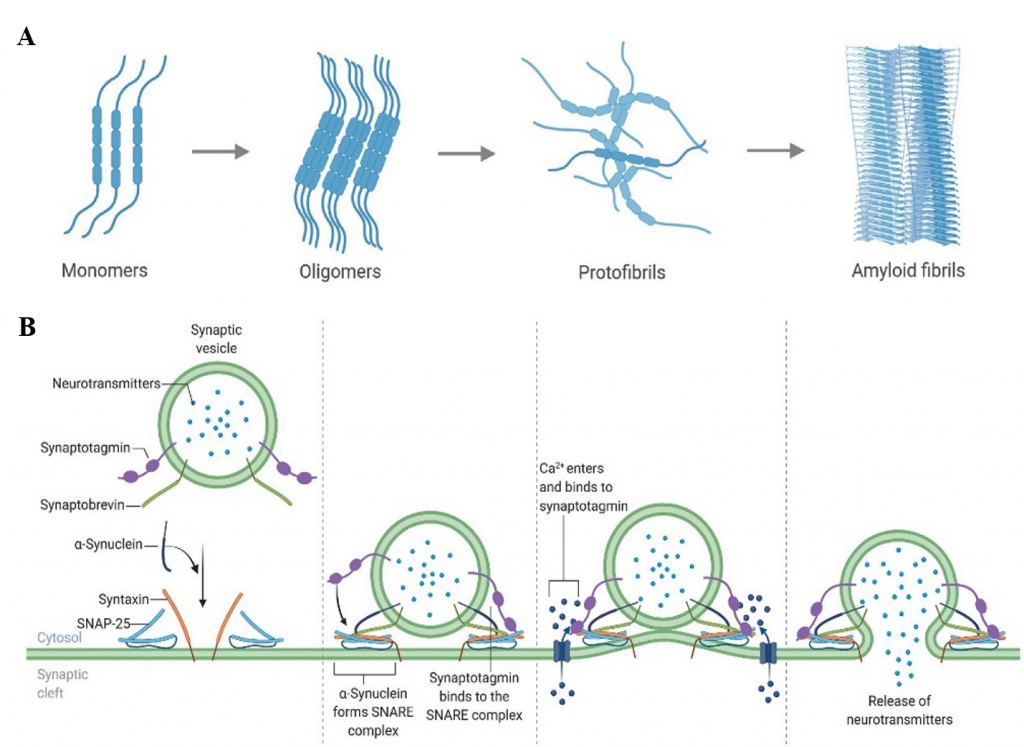
(A) 錯誤折疊的 α-突觸核蛋白聚集體的過程 。 在正常情況下 α-突觸核蛋白以未摺疊的單體形式存在。然而,在突變、增殖或錯誤的轉譯後修飾的情況下,α-突觸核蛋白開始形成寡聚體,這些寡聚體招募更多的單體,最終形成有毒的β-摺疊富含的澱粉樣原纖維,形成稱為「路易體」的致命聚集體,導致神經變性和細胞死亡。
(B) α-突觸核蛋白促進神經傳遞的機制。α-突觸核蛋白主要存在於主要存在於神經元突觸末端,參與調節參與調節突觸囊泡的運輸和釋放。它與突觸囊泡的附著、聚集和融合過程有關,並且調節神經傳遞物質的釋放。
儘管α-突觸核蛋白在神經退化性疾病中起著重要作用 ,但其在病症的起始和進展中的生物學作用以及信號傳遞機制尚未被完全了解 。 由於缺乏關於α-突觸核蛋白的生物學功能、信號傳遞和交互作用的見解,使我們對神經退化性疾病背後分子機制的理解不足,這也限制了神經退化性疾病的早期診斷和療法的發展 。 因此,本研究旨在透過 IPA來探討以下問題 :
- α-突觸核蛋白的經典信號路徑和生物學功能為何 ?
- α-突觸核蛋白基因SNCA的交互作用網路及上游調控因子為何 ?
- α-突觸核蛋白的毒性路徑為何 ?
作者以關鍵字 「 Alpha-synuclein (α-突觸核蛋白 )」 在 NCBI資料庫中搜尋 α-突觸核蛋白和相關基因,並僅限於人類基因相關研究 。截至 2021 年 8 月 26 日, NCBI 資料庫中總共有 215 個α-突觸核蛋白相關基因,之後運用 IPA進行分析。
α-突觸核蛋白經典路徑、交互作用網路分子和病理學意義的預測
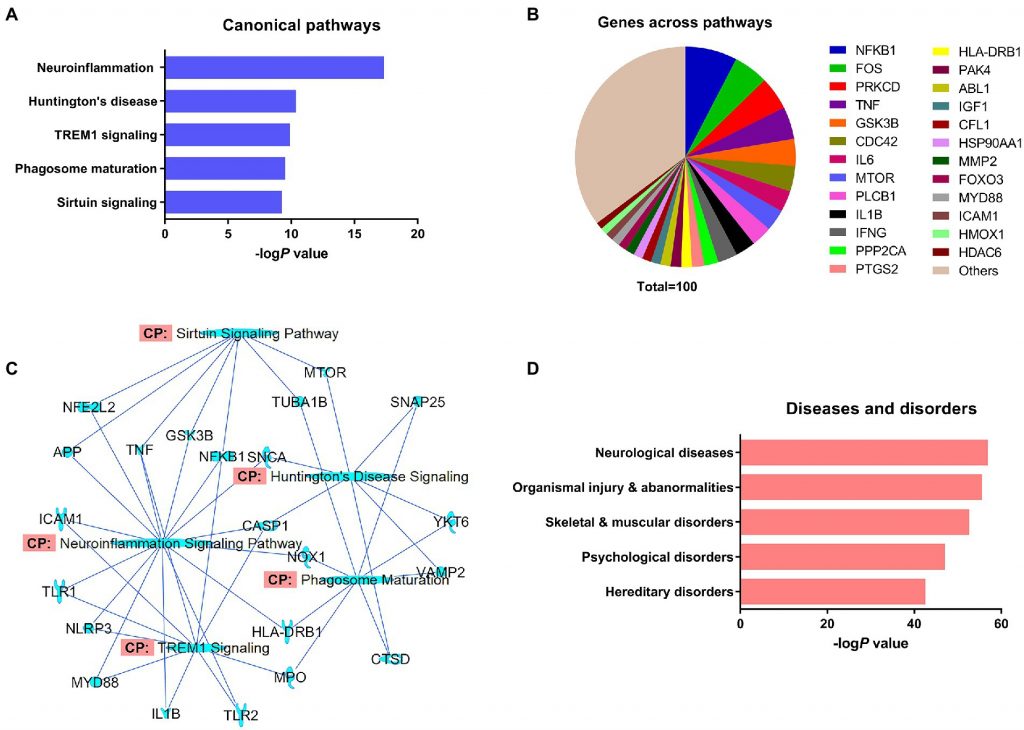
作者使用IPA 預測了α-突觸核蛋白的 426 條經典信號路徑(圖 1A)。 其中神經發炎 是α-突觸核蛋白預測信號路徑中最重要的,其次是 亨丁頓舞蹈症,骨髓細胞表達的可溶解觸發受體 (TREM1),吞噬體成熟和 Sirtuin 信號通路 。 接下來,作者整理 NCBI 資料集的α-突觸核蛋白及其交互作用的伙伴基因所出現的路徑並進行了頻率分佈分析(圖 1B)。分析結果顯示NF-κB蛋白亞基 1 基因(NFKB1) 在各路徑中佔有最高的數量比例 (7.6%),其次是 Fos 原癌基因 AP-1 轉錄因子亞基(FOS 5.1%)、蛋白激酶 C δ型 (PRKCD 4.9%)。 進一步作者重疊了主要的經典信號通路和這些通路中的 NCBI 資料集基因 (圖1C), 結果顯示神經發炎是重疊程度最高的 路徑,且其分子與TREM1和 Sirtuin信號通路之間呈現更緊密的關聯 。 在針對 α-突觸核蛋白的病理作用的分析中 (圖1D),觀察到其和神經系統疾病的關聯性最為密切 ,其次包括機體損傷和異常、骨骼和肌肉疾病、心理障礙和遺傳性疾病 。
(A) α-突觸核蛋白的前五經典路徑 。 (B) 來自 NCBI 資料集的 α-突觸核蛋白相關基因出現在預測的調控路徑中的頻率分布。(C) 資料集中α-突觸核蛋白及相關基因 和前五調控路徑重疊網路圖 。 (D) α-突觸核蛋白的前五疾病。
主要的SNCA 基因交互作用網路的分子活性預測分析
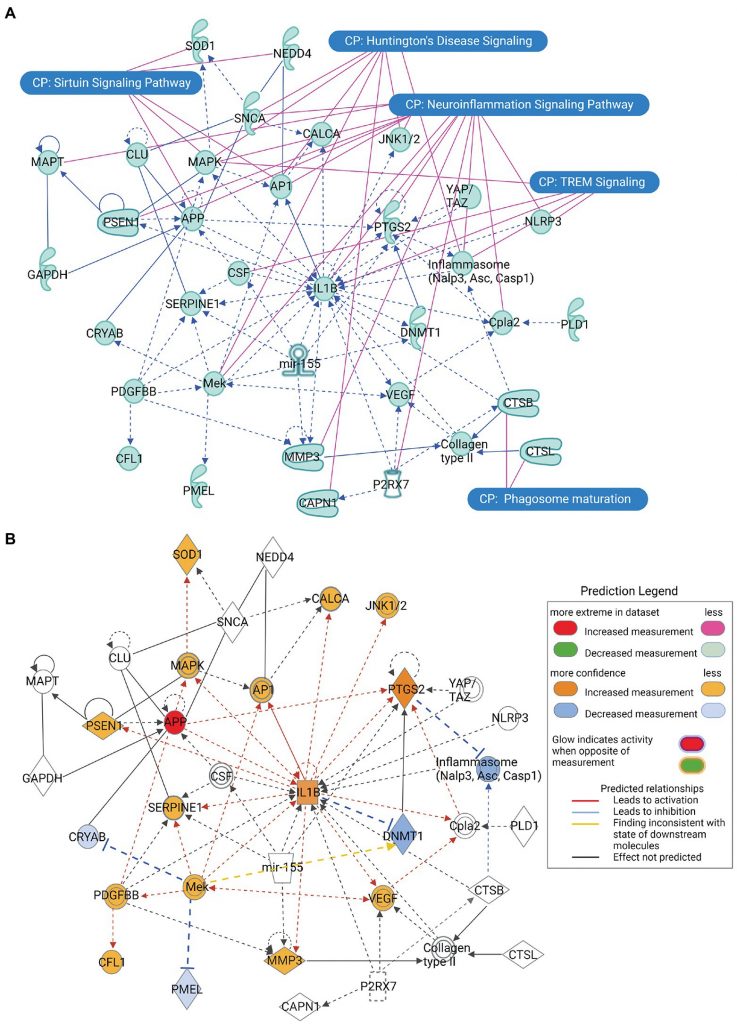
α-突觸核蛋白基因( SNCA)除了在神經發炎和亨丁頓舞蹈症中發揮關鍵作用外, SNCA還與澱粉樣β前體蛋白( APP)、簇蛋白 CLU)和神經前體細胞表達發育下調蛋白 4 NEDD4 交互作用,並與降鈣素相關多肽 α (CALCA) 和超氧化物歧化酶 1 (SOD1) 間接交互作用 (圖 2A) 。 並觀察到APP活性的增加會導致促發炎基因 IL1B 和前列腺素內過氧化物合酶 2 (PTGS2)活化 ,進而活化與SNCA 的直接相關的基因 CALCA 和 SOD1 圖 2B)。
(A) SNCA 的主要交互作用網路。 (B) SNCA 主要相互作用網路的分子活性預測分析,描述了APP 活性的增加導致一系列基因的活化和抑制。
SNCA上游調控因子預測
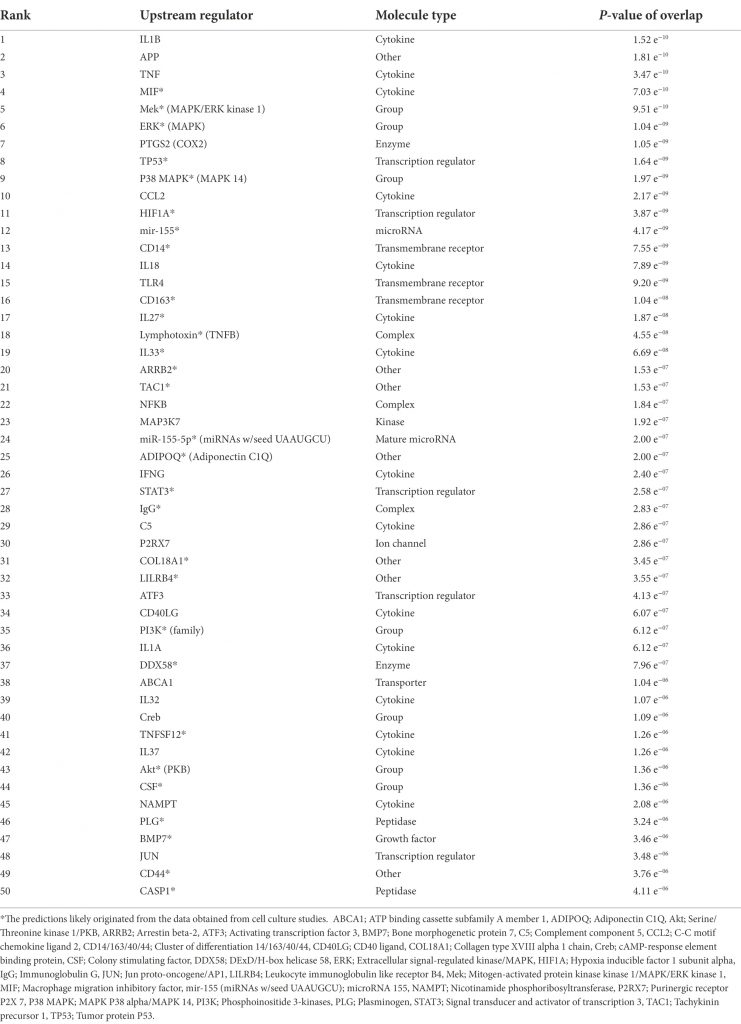
除了對經典信號通路、 交互作用網路以及疾病和生物學功能的預測外 ,α-突觸核蛋白NCBI基因資料集的核心分析還預測了 SNCA的上游調控因子 (表格 1)。 研究發現上游調控因子中存在著 APP該因子與突觸核蛋白的病變過程相關。 由於蛋白質聚集的形成與神經發炎相關,因此研究觀察到大量存在細胞因子( IL1B、 TNF、 MIF、 CCL2、 IL18、 IL27、淋巴毒素、 IL33、 IFNG、 IgG 和
C5)、 發炎介質 (PTGS2/COX2)、跨膜受體介導先天免疫( CD14、 TLR4 和 CD163 等 上游調節因子, 證實神經發炎是大腦中突觸核蛋白病的標誌。
α-突觸核蛋白、β 澱粉樣蛋白、濤 蛋白 (Tau)和 亨丁頓蛋白 (HTT)的 IPA 毒性分析
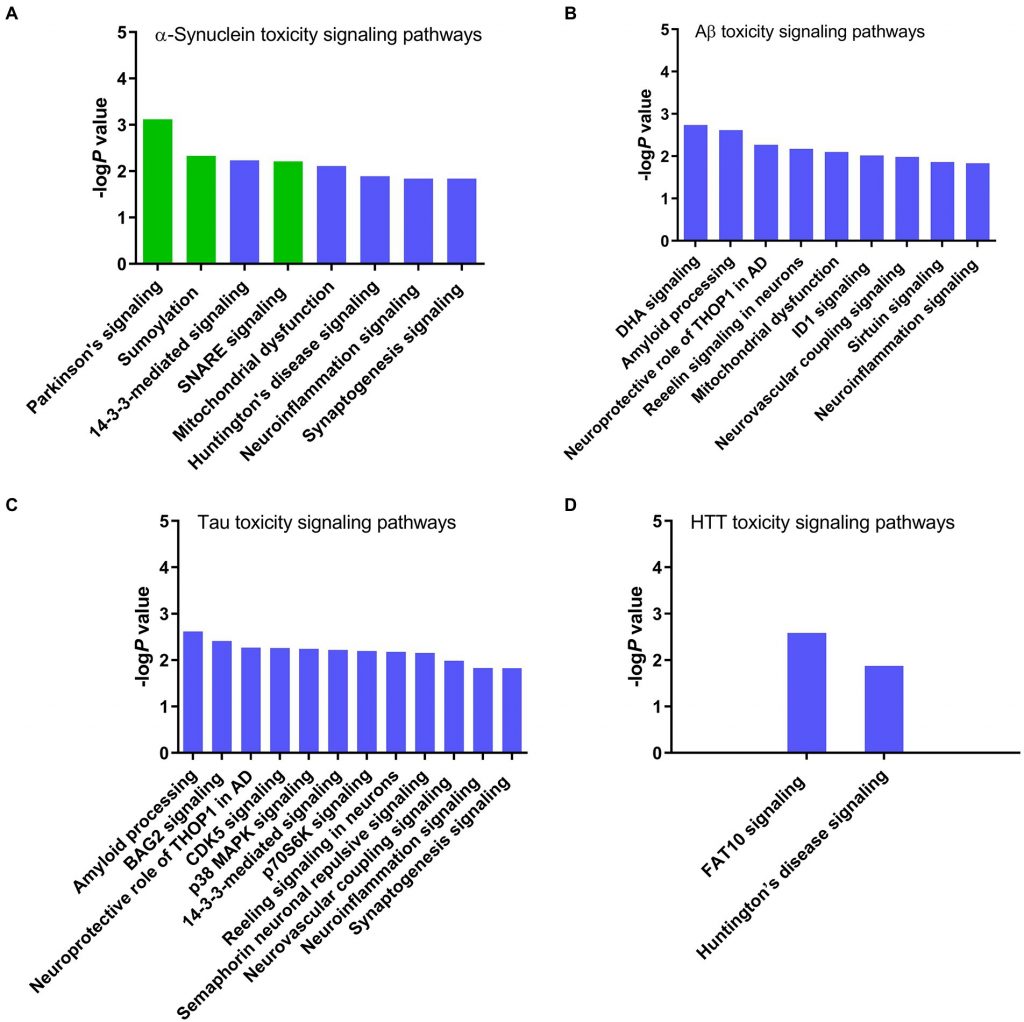
為了釐清 α-突觸核蛋白特有的毒性路徑和分子機制,研究團隊展開了對α-突觸核蛋白的毒性分析。這項分析確定了與α-突觸核蛋白相關毒性的經典信號傳遞路徑,包括帕金森氏症後的線粒體功能受損、亨丁頓舞蹈症、以及神經發炎等 (圖 4A )。
為了排除可能由細胞壓力反應或亨丁頓蛋白而引起的α-突觸核蛋白毒性路徑,作者分析了其他神經退化致病蛋白的毒性特徵,例如β澱粉樣蛋白 (圖 4B)、濤 蛋白 (圖 4C)和亨丁頓蛋白 (圖 4D)。發現14-3-3蛋白、線粒體功能損傷 、亨丁頓舞蹈 症 、神經發炎和突觸信號傳遞等路徑可能是由於細胞壓力反應而被活化,而不是直接由α-突觸核蛋白造成的毒性。相反 的 , α-突觸核蛋白毒性獨有的帕金森氏症、類小泛素化修飾和 SNARE信號路徑可能是由 α-突觸核蛋白直接致病性的結果。
(A) α-突觸核蛋白、 (B) β 澱粉樣蛋白、 (C) 濤蛋白和 (D)亨丁頓蛋白。
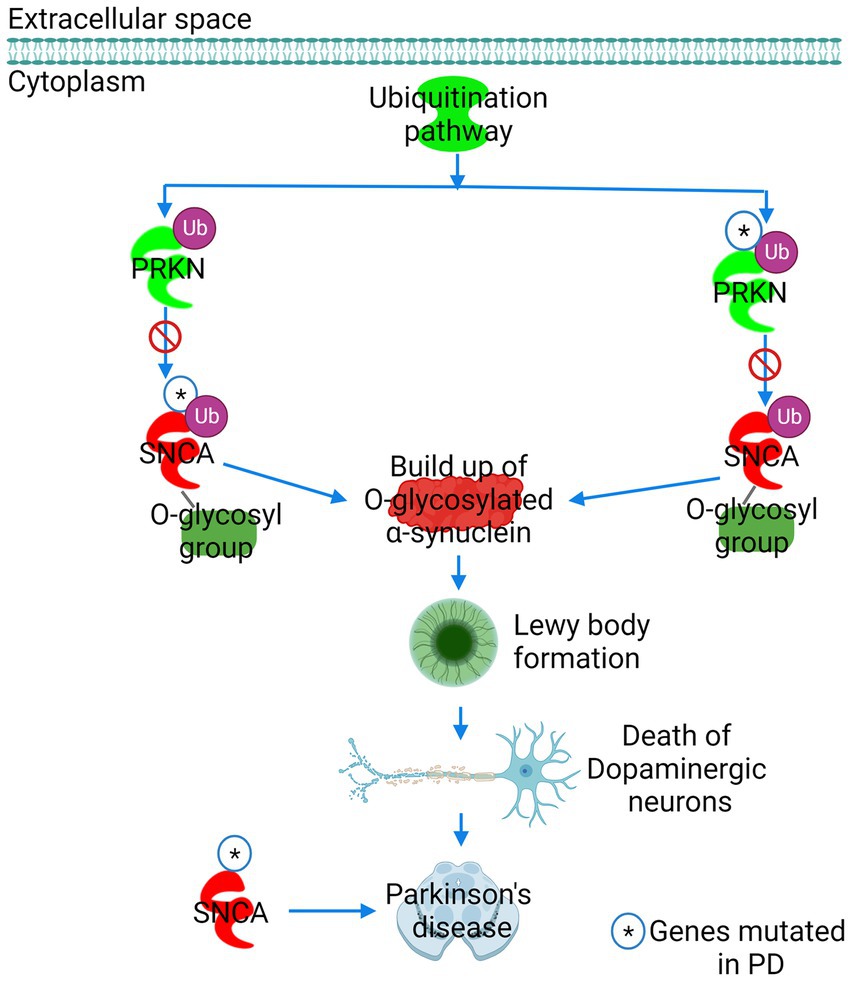
帕金森氏症被視為α 突觸核蛋白毒性的主要路徑 。 在正常細胞狀態下, PARK2 基因所轉譯出的Parkin 蛋白扮演著關鍵角色,它具有泛素化能力可以標記過量或異常的蛋白質,然後通過蛋白酶降解進行調節,這是維持蛋白質質量的重要機制之一。 根據 IPA 預測,由於 Parkin (PARK2) 或 α-突觸核蛋白基因 (SNCA) 的突變, Parkin 無法與糖基化的 α-突觸核蛋白結合。 導致糖基化狀態的α-突觸核蛋白隨後在神經元細胞中積累,形成路易體最終使多巴胺神經元死亡和帕金森氏症發展(圖 5)。
這項研究是首次使用 IPA對α-突觸核蛋白的信號路徑、網 路分子、生物功能和作用進行分析 。 而IPA為這篇研究提供了以下的分析方法 :
- α-突觸核蛋白經典路徑的預測
作者使用 IPA 的核心分析預測了α α-突觸核蛋白的 426 條經典信號路徑。發現 神經發炎訊號路徑被預測為α-突觸核蛋白最重要的路徑,其次是亨丁頓舞蹈症 、 TREM1信號通路、吞噬體成熟和 sirtuin信號通路 。 隨後,作者進一步分析了這些路徑中α-突觸核蛋白的資料集基因分佈從 NCBI資料 集的 215個基因中,共有 168個基因在預測的路徑中出現了 1942次 。 此外,分析發現 MTOR (3.1%) 和 GSK3B (4.0%)等分子參與引導α α-突觸核蛋白的聚集,進而失調 PRKCD (4.9%) 和 CDC42 (3.7%)的活性,導致神經元結構紊亂和神經炎症。 - α-突觸核蛋白相關疾病的預測
透過 IPA的核心分析,研究者預測 了α α-突觸核蛋白相關的疾病和生物學功能 結果顯示 SNCA基因異常主要導致神經系統疾病、器官損傷和異常、骨骼和肌肉疾患、心理障礙以及遺傳性疾病 。 目前的研究亦指出 α-突觸核蛋白表達異常引發了 α-突觸核蛋白單體的聚集,最終形成路易體 ,這是帕金森氏症 、路易體失智症和多系统萎缩的病理特徵 。 - 主要與 SNCA 基因交互作用網路的分子活性預測分析
IPA 預測了 SNCA 基因的幾個交互作用網路,發現其中的 APP、 CLU、 CALCA 和 SOD1 基因可能導致α-突觸核蛋白相關的突觸核蛋白疾病 。 - SNCA基因的上游調控因子預測
探討上游 SNCA 基因的上游調控因子, 有助於理解神經發炎和先天免疫反應 的發生。 IPA的分析中發現, 大量存在細胞因子、 發炎介質、跨膜受體介導先天免疫等上游調控因子,證實神經發炎是大腦中突觸核蛋白病的特徵 。 - SNCA、 APP、 MAPT、 HTT毒性信號路徑分析
IPA 的毒性分析協助 鑑 定α-突觸核蛋白毒性特有的路徑和網路分子同時排除由 細胞壓力反應或亨丁頓蛋白等引起的毒性路徑,最後發現帕金森氏症 、 類小泛素化修飾和 SNARE 信號路徑可能是 由 α-突觸核蛋白獨有的致病機制 。
這項研究結果有助於深入了解與α-synuclein相關的疾病機制 ,也提供了一個很好的 IPA分析範例,讓我們了解如何利用 IPA分析信號傳遞、分子交互作用網路和生物學功能以幫助我們從研究資料中整理出重要的訊息。
參考資料
Suthar SK, Lee SY. Ingenuity pathway analysis of α-synuclein predicts potential signaling pathways, network molecules, biological functions, and its role in neurological diseases. Front Mol Neurosci. 2022;15:1029682. Published 2022 Nov 29.